Thuốc Toulalan 50mg Davipharm (Hộp 6 vỉ x 10 viên)
👁 47,987 lượt xem
Chỉ định: Thuốc Toulalan 50mg chữa trị các triệu chứng dạ dày – ruột gây ra bởi viêm dạ dày mạn (cảm giác đầy chướng bụng, đau bụng trên, chán ăn, ợ nóng, buồn nôn và nôn.
Đối tượng sử dụng: Người mắc các triệu chứng dạ dày – ruột gây ra bởi viêm dạ dày mạn
Quy cách đóng gói: Hộp 6 vỉ x 10 viên nén bao phim.
Chi tiết sản phẩm
Thành phần công thức thuốc Toulalan 50mg
Mỗi viên nén bao phim chứa:
Thành phần dược chất: Itopride HCl 50mg
Thành phần tá dược: Lactose monohydrat, cellulose vi tinh thể M101, povidon (kollidon 30), crospovidon, magiê stearat, HPMC E6, talc, titan dioxid, PEG 4000, polysorbat 80, dầu thầu dầu.
Thuốc Toulalan 50mg
Dạng bào chế của thuốc Toulalan 50mg
Viên nén tròn, bao phim, màu trắng, một mặt có dập logo, mặt kia có dập gạch ngang.
Chỉ định của thuốc Toulalan 50mg
Chữa trị những triệu chứng về dạ dày – ruột gây ra bởi viêm dạ dày mạn (cảm giác đầy chướng bụng, đau bụng trên, chán ăn, ợ nóng, buồn nôn và nôn).
Cách dùng, liều dùng của thuốc Toulalan 50mg
Liều uống thông thường cho người lớn là 150mg Itopride HCl (3 viên) mỗi ngày, chia 3 lần, mỗi lần 1 viên, uống trước bữa ăn. Liều này có thể giảm bớt tuỳ thuộc vào tuổi tác và bệnh trạng của từng bệnh nhân.
Chống chỉ định của thuốc Toulalan 50mg
Bệnh nhân có tiền sử mẫn cảm với bất kỳ thành phần nào của thuốc.
Không dùng cho phụ nữ có thai, hoặc cho con bú, trừ khi thực sự cần thiết.
Cảnh báo và thận trọng khi dùng thuốc Toulalan 50mg
Nên lưu ý khi sử dụng vì thuốc này làm tăng hoạt tính của acetylcholin.
Không nên dùng kéo dài khi không thấy có sự cải thiện về những triệu chứng của dạ dày – ruột.
Sử dụng thuốc cho người cao tuổi
Vì chức năng sinh lý ở người cao tuổi giảm, nên những tác dụng không mong muốn dễ xảy ra hơn. Do đó, những bệnh nhân cao tuổi sử dụng thuốc này nên được theo dõi cẩn thận, nếu có bất kỳ tác dụng không mong muốn nào xuất hiện nên sử dụng những biện pháp xử trí thích hợp, ví dụ như giảm liều hoặc ngừng thuốc.
Sử dụng trong nhi khoa
Độ an toàn của thuốc trên trẻ em vẫn chưa được xác định (còn có ít bằng chứng lâm sàng).
Thận trọng về tá dược:
Sản phẩm có chứa lactose. Bệnh nhân bị bệnh di truyền hiếm gặp kém dung nạp galactose, thiếu hụt Lapp lactase hoặc rối loạn hấp thu glucose – galactose không nên sử dụng.
Sản phẩm có chứa dầu thầu dầu có thể gây đau bụng, tiêu chảy.
Sản phẩm có chứa polysorbat 80 có thể gây dị ứng.
Những thận trọng khi phân phối thuốc:
Đối với những thuốc đóng trong vỉ bấm (PTP), hướng dẫn bệnh nhân lấy thuốc ra khỏi bao bì trước khi sử dụng. (Đã có báo cáo rằng, nếu tấm PTP bị nuốt, góc sắc nhọn của nó có thể đâm thủng thực quản gây nên biến chứng rất nghiêm trọng.
Sử dụng thuốc Toulalan 50mg cho phụ nữ có thai và cho con bú
Phụ nữ mang thai:
Thuốc này chỉ nên sử dụng ở phụ nữ có thai, hoặc ở phụ nữ có thể mang thai chỉ khi lợi ích mong muốn của trị liệu lớn hơn những rủi ro có thể gặp phải (Sự an toàn của sản phẩm này ở phụ nữ có thai vẫn chưa được xác định).
Phụ nữ cho con bú:
Tốt nhất là không nên sử dụng thuốc này trong thời kỳ cho con bú, nhưng nếu cần thiết, tránh cho con bú trong quá trình điều trị. (Đã có báo cáo cho thấy Itopride HCl được bài tiết qua sữa ở những thí nghiệm trên động vật (chuột cống). (Xem phần Dược động học).
Ảnh hưởng của thuốc Toulalan 50mg lên khả năng lái xe và vận hành máy móc
Tác dụng không mong muốn như chóng mặt có thể xảy ra. Khả năng lái xe và vận hành máy móc có thể bị giảm xuống.
Tương tác, tương kỵ của thuốc Toulalan 50mg
Nên lưu ý khi dùng kết hợp Itopride HCl với những thuốc sau:
| Thuốc |
Dấu hiệu, triệu chứng và điều trị |
Cơ chế tác dụng và những yếu tố rủi ro |
|
Những thuốc kháng cholinergic: Tiquizium bromide, scopolamine butyl bromide, timepidium bromide,… |
Triệu chứng: Có thể làm giảm tác dụng tăng nhu động dạ dày – ruột của Itopride (tác dụng cholinergic) |
Cơ chế: Tác dụng ức chế của những thuốc kháng cholinergic có thể có tác dụng dược lý học đối kháng tác dụng của Itopride |
Tác dụng không mong muốn của thuốc Toulalan 50mg
Tại thời điểm thuốc được cấp phép lưu hành tại Nhật: Những tác dụng không mong muốn được thấy ở 14 (2,45%) trên 572 bệnh nhân (19 trường hợp; 3,32%(. Tác dụng không mong muốn chủ yếu là tiêu chảy (4 trường hợp; 0,7%), đau đầu (2 trường hợp; 0,35%), đau bụng (2 trường hợp; 0,35%). Những bất thường về các dữ liệu xét nghiệm là giảm bạch cầu (4 trường hợp), tăng prolactin (2 trường hợp)…
Tại thời điểm đánh giá lại: Những tác dụng không mong muốn được thấy ở 74 (1,25%) trên 5.913 bệnh nhân (104 trường hợp; 1,76%). Những tác dụng không mong muốn chính có bất thường về các dữ liệu xét nghiệm là tiêu chảy (13 trường hợp; 0,22%), đau bụng (8 trường hợp; 0,14%), táo bón (8 trường hợp; 0,14%), tăng AST (GOT) (8 trường hợp; 0,14%), tăng ALT (GPT) (8 trường hợp; 0,14%)…
* Những tác dụng không mong muốn có ý nghĩa lâm sàng:
– Sốc và phản ứng quá mẫn (tỷ lệ mắc chưa được biết): Sốc và phản ứng quá mẫn có thể xuất hiện, và nên theo dõi bệnh nhân chăt chẽ. Nếu thấy bất kỳ dấu hiệu nào của sốc và phản ứng quá mẫn, ví dụ như tụt huyết áp, khó thở, phù thanh quản, nổi mày đay, tái nhợt và toát mồ hôi,… nên ngừng ngay thuốc và có những biện pháp điều trị thích hợp.
– Rối loạn chức năng gan và vàng da (tỷ lệ mắc chưa được biết): Rối loạn chức năng gan và vàng da, cùng với tăng AST (GOT), ALT (GPT) và γ-GTP,… có thể xuất hiện, và bệnh nhân nên được theo dõi chặt chẽ. Nếu phát hiện thấy những triệu chứng bất thường trên, nên ngừng ngay thuốc và có những biện pháp điều trị thích hợp.
* Những tác dụng không mong muốn khác (AR)
|
0,1% < AR < 5% |
AR < 0,1% |
Tỷ lệ mắc chưa biết(1) |
|
Quá mẫn (2) |
Phát ban, mẩn đỏ, ngứa |
|
|
Triệu chứng ngoại tháp (2) |
Run rẩy… |
|
|
Nội tiết (2) |
Tăng prolactin… |
Chứng to vú ở đàn ông |
|
Huyết học (2) |
Giảm tiểu cầu, giảm bạch cầu… |
|
|
Đường tiêu hoá |
Tiêu chảy, táo bón, đau bụng… |
Buồn nôn, tăng tiết nước bọt… |
|
Tâm thần |
Đau đầu, cảm giác khó chịu, rối loạn giấc ngủ, chóng mặt,… |
|
|
Gan |
Tăng AST (GOT), tăng ALT (GPT)… |
Tăng γ-GTP, tăng AI-P |
|
Thận |
Tăng BUN, tăng creatinin… |
|
|
Các loại khác |
Đau lưng hoặc ngực, mệt mỏi… |
Ghi chú:
(1) Tỷ lệ mắc chưa được biết do đây là những báo cáo tự phát.
(2) Nếu có bất kỳ dấu hiệu bất thường nào được phát hiện, nên có những biện pháp xử trí thích hợp, ví dụ như ngừng dùng thuốc…
Đặc tính dược lực học của thuốc Toulalan 50mg
1/ Cơ chế tác dụng:
Itopride HCl làm tăng sự giải phóng acetylcholin (ACh) do tác dụng đối kháng với thụ thể D2 dopamin, và ức chế sự phân huỷ acetylcholin được giải phóng qua việc ức chế acetylcholin esterase, dẫn đến làm tăng nhu động dạ dày – ruột.
2/ Làm tăng nhu động dạ dày – ruột:
– Làm tăng nhu động dạ dày: Itopride HCl làm tăng nhu động dạ dày của chó lúc thức, phụ thuộc vào liều.
– Tăng khả năng làm rỗng dạ dày: Itopride HCl làm tăng khả năng rỗng dạ dày ở người, chó, chuột cống.
3/ Làm giảm nôn:
Itopride HCl ức chế nôn ở chó gây ra bởi apomorphin, tác dụng này phụ thuộc vào liều.
Đặc tính dược động học của thuốc Toulalan 50mg
1/ Nồng độ trong huyết thanh:
Nồng độ trong huyết thanh và những thông số dược động học ở người lớn khỏe mạnh, sau một liều đơn uống 50mg Itopride HCl lúc đói được chỉ rõ trong hình 1 và bảng 1.
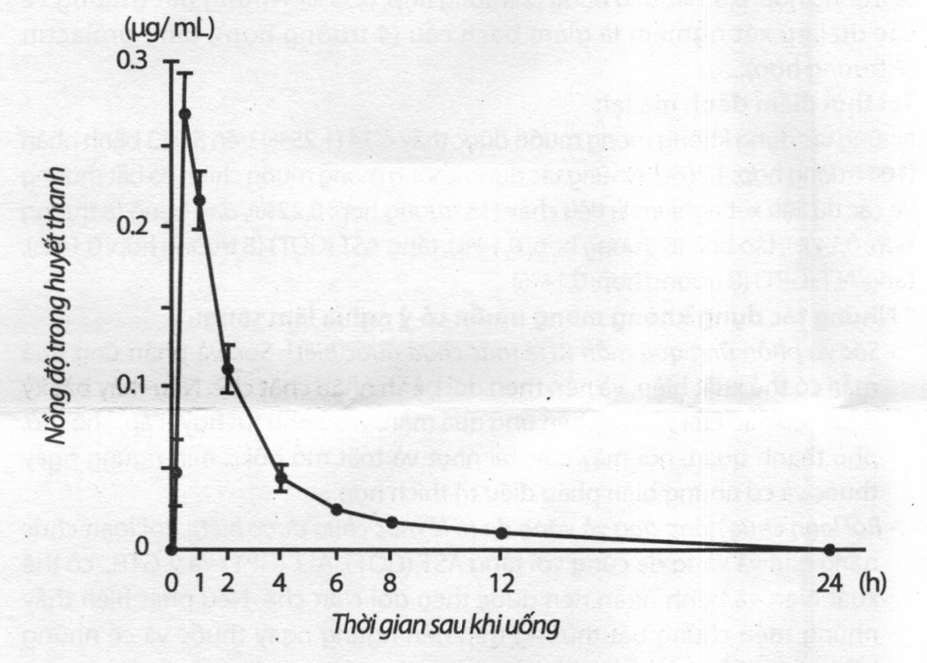
Hình 1: Nồng độ trong huyết thanh sau một liều đơn uống 50mg Itopride HCl (người lớn khỏe mạnh lúc đói, giá trị trung bình ± S.E.).
Bảng 1: Các thông số dược động học
| Liều (mg) | Cmax (μg/mL) | Tmax (giờ) | AUC0→∞ (μg.giờ/mL) | T1/2 (giờ) |
| 50 | 0,28 ± 0,02 | 0,58 ± 0,08 | 0,75 ± 0,05 | 5,77 ± 0,33 |
Giá trị trung bình độ lệch chuẩn, n=6
2/ Phân bố:
Kết quả thu được từ những thí nghiệm trên động vật:
– Nồng độ tối đa đạt được ở hầu hết tất cả các mô từ 1 đến 2 giờ sau liều uống đơn 5 mg/kg 14C-Itopride HCl ở chuột cống, và 2 giờ sau khi uống đạt nồng độ cao ở thận, ruột non, gan, tuyến thượng thận, dạ dày (theo mức độ giảm dần từ cao xuống thấp), và phần thuốc đi vào hệ thống thần kinh trung ương, như não và tuỷ sống, là rất ít.
– Khi đưa 14C-Itopride HCl với liều 5 mg/kg vào tá tràng cho chuột cống, nồng độ hoạt tính phóng xạ trong những lớp cơ dạ dày cao hơn khoảng 2 lần so với nồng độ trong máu.
– Sự bài tiết qua sữa: Khi dùng liều uống 5 mg/kg 14C-Itopride HCl cho chuột cống, nồng độ hoạt tính phóng xạ trong sữa so với trong huyết thanh cao hơn 1,2 lần về Cmax; cao hơn 2,6 lần về AUC và cao hơn 2,1 lần về T1/2.
3/ Chuyển hoá và thải trừ:
– Ở liều uống đơn 100mg Itopride HCl dùng cho người lớn khỏe mạnh (6 nam giới) khi đói, tỷ lệ bài tiết qua nước tiểu trong vòng 24 giờ sau khi uống cao nhất là dạng N-oxide [67,54% của liều dùng (89,41% của phần bài tiết qua nước tiểu)], và sau đó là dạng thuốc không đổi (4,14%), và những chất còn lại là không đáng kể.
– Trong những thí nghiệm sử dụng microsome biểu thị CYP, hoặc flavin monooxygenase (FMO) của người, cho thấy FM01 và FM03 tham gia tạo chất chuyển hoá chính N-oxide. Tuy nhiên, không phát hiện thấy hoạt tính N-oxygenase của CYP1A2, -2A6, -2B6, -2C8, -2C9, -2C19, -2D6, -2E1 hoặc -3A4.
4/ Các vấn đề khác:
Tỷ lệ liên kết protein huyết thanh: Tỷ lệ liên kết protein huyết thanh là 96% sau khi dùng liều đơn uống 100mg Itopride HCl cho người khoẻ mạnh (6 nam giới) khi đói.
Nghiên cứu lâm sàng về thuốc Toulalan 50mg
Những nghiên cứu lâm sàng mở và những nghiên cứu so sánh mù đôi của Itopride HCl đã được tiến hành. Kết quả cho thấy tỷ lệ có hiệu lực của Itopride HCl đối với những triệu chứng về dạ dày – ruột ở bệnh viêm dạ dày mạn là 77,6% (277/357 bệnh nhân) cho những trường hợp có cải thiện từ mức trung bình trở lên (tại thời điểm thuốc được cấp phép lưu hành).
Quy cách đóng gói của thuốc Toulalan 50mg
Hộp 6 vỉ x 10 viên
Điều kiện bảo quản, hạn dùng và tiêu chuẩn chất lượng của thuốc Toulalan 50mg
Điều kiện bảo quản của thuốc Toulalan 50mg
Nơi khô ráo, tránh ánh sáng, nhiệt độ không quá 30 độ C.
Hạn dùng của thuốc Toulalan 50mg
36 tháng kể từ ngày sản xuất.
Tiêu chuẩn chất lượng của thuốc Toulalan 50mg
TCCS.
Ngày xem xét sửa đổi và cập nhật lại nội dung hướng dẫn sử dụng của thuốc Toulalan 50mg
06/12/2018.
Lưu ý: Sản phẩm này là thuốc, chúng tôi chỉ bán khi có chỉ định của bác sĩ. Mọi thông tin trên Website chỉ mang tính chất tham khảo, bệnh nhân và thân nhân không được tự ý sử dụng thuốc.